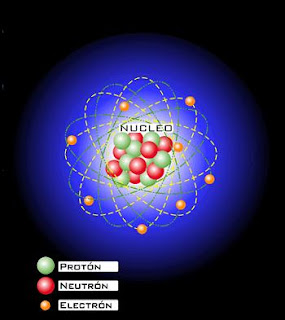
Un átomo esta formado por un núcleo donde existen protones (positivos) y neutrones. Alrededor de ese núcleo giran los electrones (negativos). El núcleo es la parte mas pequeña del átomo, no obstante el núcleo es lo que más pesa, es decir, el núcleo es lo que le da peso al átomo.
Entonces si en el núcleo hay protones y neutrones, los cuales representan el mayor porcentaje del peso total del átomo, se puede deducir que:
Peso atómico= protones +neutrones.
El número atómico (Z) equivale al número de protones, y el número de electrones es igual al número de protones. Entonces, si el número atómico de un elemento es 25, quiere decir que tiene 25 protones y 25 neutrones. Esta regla sólo se cumple cuando se está trabajando con un átomo neutro. Si se está trabajando con un átomo que no es neutro lo que pasa es que si va acompañado de un número positivo, se le resta al número de protones y se obtienen los electrones, o si va acompañado de un número negativo, se le suma al número de protones y se obtienen los electrones.
Ejemplo:
S (azufre):
Z=16
Entonces tiene 16 protones y 16 neutrones.
A= 32
Neutrones= A-protones
Neutrones= 16
Pero si se está trabajando con un átomo que no es neutro sería así:
S2
Z=16
Protones=16
Electrones= # de protones -2
Electrones= 14
Neutrones= 16
S-2
Z=16
Protones= 16
Electrones= # de protones +2
Electrones= 18
Neutrones= 16
Para hallar el número de neutrones en un átomo se sigue el siguiente procedimiento:
1. Se averigua el número de masa (A) del elemento
2. A este número se le resta el número de protones o Z. Así se obtienen los neutrones.

Gracias me ha servido de mucha ayuda
ResponderEliminaresta bien gracias
ResponderEliminarahhhh pero solo se entiendo un poco
ResponderEliminargenial gracias
ResponderEliminargenial, y muy claro.
ResponderEliminarsi me sirvió mucho gracias
ResponderEliminarMuchas gracias, full copiada que me pegué en el exámen gracias a ustedes, cracks
ResponderEliminarAlgo confuso pero cool jajaja (sólo es mi cerebro de lento aprendizaje), gracias!
ResponderEliminarHay un error en "quiere decir que tiene 25 protones y 25 neutrones" en vez de neutrones es electrones
ResponderEliminar