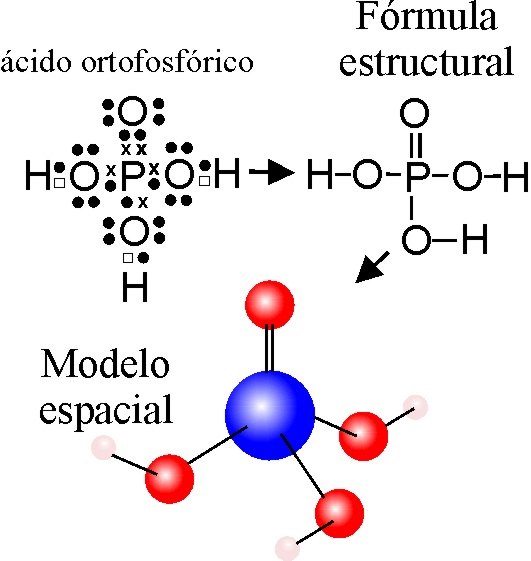
Es la representación de los elementos que conforman un compuesto. La fórmula química da información sobre los átomos que conforman la molécula, en ella también se pueden encontrar datos referentes a la unión de los átomos que la conforman por medio de enlaces químicos.
Existen varios tipos de formulas químicas a conocer:
- Formula Química Mínima: Se denomina formula empírica y es la que indica el tipo de átomos presentes en un compuesto y da la relación entre el número de átomos de cada clase presentes en la formula.


- Formula Química Molecular: Indica el numero de átomos presentes en un compuesto molecular y la cantidad de átomos de cada clase presentes el ella. La formula molecular se usa únicamente en los compuestos covalentes. En una formula molecular el sub-índice indica el numero de átomos presentes en una molécula de un compuesto.


- Formula Química Estructural: Indican la forma en que los átomos de los elementos se encuentran enlazados en una molécula. En ella se describe la estructura molecular del compuesto empleado. Este tipo de formula se aplica básicamente en la química orgánica.